The Science Dog
Il termine “microbioma” è di gran moda tra i ricercatori e i cinofili in questi giorni. Nella maggior parte dei casi, quando si sente questo termine, ci si riferisce al microbioma intestinale del cane. Tuttavia, un altro importante sito nel corpo del cane è la pelle. Come l’intestino, la composizione batterica della pelle è multispecie, varia notevolmente da cane a cane ed è importante per la salute dell’individuo. Sono stati osservati cambiamenti nel microbioma cutaneo del cane in presenza di alcune malattie della pelle e in risposta agli allergeni ambientali. Tuttavia, non è ancora noto come il cibo che i cani mangiano influenzi il loro microbioma cutaneo. Ad esempio, l’alimentazione di cibo fresco, moderatamente processato porta allo sviluppo di diversi tipi di batteri sulla pelle rispetto all’alimentazione di cibo secco estruso? Un gruppo di ricercatori si è recentemente posto questa domanda (1).
IL CIBO CHE SOMMINISTRIAMO INFLUENZA IL MICROBIOMA CUTANEO DEI NOSTRI CANI?
Lo studio
L’obiettivo primario di questo studio pilota era quello di esaminare gli effetti di una dieta fresca-cotta (cioè cibi moderatamente lavorati) e di una dieta estrusa secca (cioè alimenti altamente lavorati) sulla composizione del microbioma cutaneo. Lo studio ha impiegato un gruppo di 7 cani adulti sani che vivevano come animali domestici. Tutti i cani sono stati alimentati per 30 giorni con un alimento fresco completo e bilanciato (Freshpet). Dopo un periodo di transizione di 4 giorni, i cani sono passati a un alimento secco estruso per cani (marca non specificata) e sono stati alimentati esclusivamente con questo alimento per 30 giorni. Al termine di ogni periodo di alimentazione di 30 giorni sono stati raccolti campioni di pelle per l’analisi batterica.
Risultati
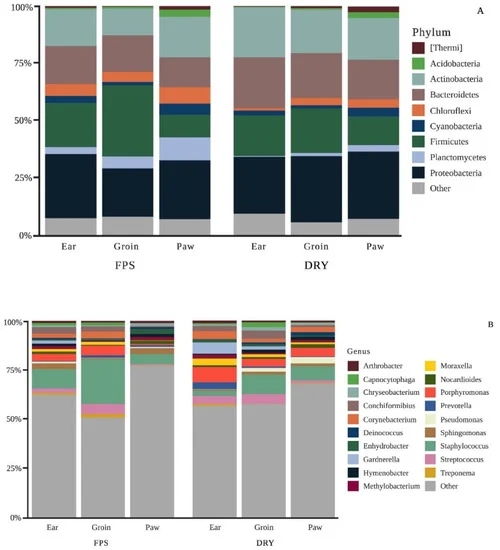
Gli alimenti freschi cotti presentavano livelli di umidità e macronutrienti più elevati, come proteine e grassi, rispetto agli alimenti secchi estrusi. La fibra alimentare aveva una percentuale significativamente più alta di fibra solubile (fermentabile) rispetto alla dieta secca.
I ricercatori hanno scoperto che il tipo di alimentazione influisce notevolmente sulla composizione del microbioma cutaneo. In particolare, la dieta ha effetti sulla diversità del microbioma. La diversità alfa -misura della quantità e del numero di differenti specie batteriche in un campione- del microbioma cutaneo è risultata significativamente più elevata quando i cani sono stati alimentati con una dieta fresca cotta per 30 giorni rispetto a quando sono stati alimentati con una dieta secca per 30 giorni. (In genere si ritiene che un’elevata diversità alfa nei campioni di microbioma sia auspicabile).
L’alimentazione di cibo fresco ha aumentato il numero totale di Staphylococcus e diminuito i generi Porphyromonas e Corynebacterium. Il significato di questi cambiamenti non è del tutto chiaro.
Conclusioni
Gli autori concludono che il passaggio da una dieta fresca (primo periodo di 30 giorni) a una estrusa secca (secondo periodo di 30 giorni) ha ridotto la diversità del microbioma cutaneo. Tuttavia, poiché sono stati somministrati diversi alimenti secchi per cani e poiché il periodo (stagione) non è stato controllato (vedi sotto), non è certo quali condizioni dietetiche o ambientali abbiano influenzato questi cambiamenti.
Limitazioni
È importante sottolineare che si tratta di un piccolo studio (pilota) con alcune limitazioni. L’aspetto forse più importante è la mancanza di controllo per l’effetto ordine. In genere, questo tipo di studio utilizza un disegno sperimentale “switch-back”. È molto semplice: metà dei cani vengono assegnati in modo casuale a ciascun tipo di alimento (cotto o secco) per i primi 30 giorni, poi passa a un altro alimento per i 30 giorni successivi. Questo disegno sperimentale avrebbe permesso ai ricercatori di controllare i cambiamenti del microbioma cutaneo legati al tempo e all’ordine che potrebbero non essere causati dalla dieta. Poiché questo non è stato fatto – tutti i cani sono stati alimentati prima con cibo fresco e poi sono passati al cibo secco – i ricercatori non possono affermare con certezza che l’alimentazione sia stata la causa della maggiore diversità del microbioma cutaneo rilevata durante i primi 30 giorni. (Personalmente immagino che il cibo abbia un effetto, ma il disegno sperimentale scelto sminuisce la portata di questo studio). Inoltre, la dimensione del campione è molto piccola, con solo sette cani che hanno completato l’intero trial. Come tale, deve essere considerato uno studio pilota o di prova (Proof-of-Concept). Questo studio suggerisce che il tipo di lavorazione utilizzato negli alimenti per cani può influenzare la diversità del microbioma cutaneo (e, in ultima analisi, la salute della pelle). Sono necessari ulteriori studi.

